
L’impact d’une espèce invasive sur son écosystème: Pterois Volitans dans la région des Caraïbes et du Golf du Mexique
INTRODUCTION
Dans le monde, les invasions biologiques restent un désastre environnemental (Ricciardi et al., 2011). Elles influencent les différents services écosystémiques affectant par la même occasion les ressources naturelles (Vila et Hulme, 2017). La gestion de ces invasions biologiques nécessite des méthodes de détection très spécifiques ainsi qu’un suivi régulier des espèces invasives responsables. Ceci requiert une source financière trop importante qui représente le principal facteur limitant cette gestion (Pimentel et al., 2005).
Une espèce invasive est dite exogène, elle provient d’un milieu extérieur avant d’être introduite dans un nouveau milieu qui peut lui paraître familier ou non. Cette introduction se fait de manière volontaire ou erronée et peut engendrer des dérèglements environnementaux au sein d’un écosystème établi. À ce jour, plusieurs espèces aquatiques invasives sont comptabilisées dans différents écosystèmes marins: le poisson-pierre en Méditerranée, l’écrevisse de Louisiane ou encore la moule zébrée provenant de la mer Caspienne. Au cours de cette étude, l’intérêt s’est porté sur Pterois volitans, plus communément appelé poisson-lion ou encore rascasse volante.
Afin de répondre à la problématique suivante: Quel est l’impact de Pterois volitans sur son écosystème tropical? Nous retracerons le contexte de son introduction dans cette région caribéenne en partant de son secteur d’origine. Nous détaillerons son cycle biologique tout en développant son anatomie. Dans un second temps nous aborderons les conséquences écologiques de cette introduction sur l’écosystème receveur. Enfin, la dernière partie de cette étude sera concentrée sur les solutions mises en place pour diminuer les différents impacts de Pterois volitans sur son milieu.
PARTIE 1: PTEROIS VOLITANS
A) Contexte, description et localisation
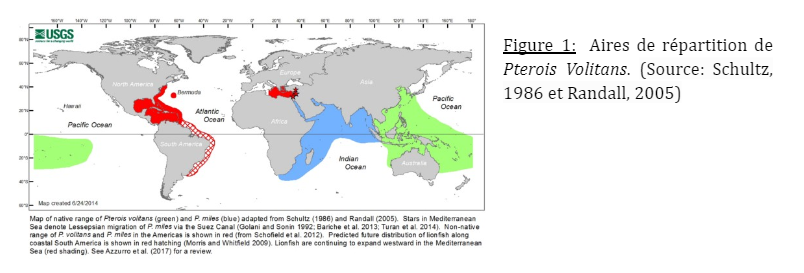
Pterois volitans, de la famille des Scorpaenidae, est un poisson tropical provenant des côtes d’Asie du Sud-Est et de l’océan Pacifique ouest. Ici, la région des Caraïbes et du Golf du Mexique.
Du fait de sa localisation, la rascasse volante nage dans des eaux chaudes se situant entre 22 et 26 degrés Celsius, à des profondeurs inférieures à 55 mètres. Cependant, il n’est pas rare d’en observer à des profondeurs bien supérieures. C’est une espèce qui privilégie les estuaires ainsi que les courants, où elle peut trouver refuge dans des amas de rochers ou récifs coralliens qui représentent un ensemble diversifié d’espèces interagissant entre elles et avec l’environnement physique (Bhattacharyya et Pal, 2011). Les juvéniles parcourent de longues distances d’où sa grande répartition géographique.
Pterois volitans a été observé pour la première fois au large de la côte sud-est de la Floride en 1985 (Mostowy et al., 2020). Cette observation pourrait être expliquée par la libération de spécimens à cause du commerce des aquariums. Depuis son arrivée, sa prolifération a été classée en 3 périodes: de 1985 au milieu des années 2000, il s’est propagé le long des côtes américaines ainsi que des Bahamas. À partir de 2006, il serait arrivé jusqu’aux îles Caraïbes. Enfin à partir de 2010 il se répand dans le Golf du Mexique. La zone colonisée par Pterois volitans ressemble fortement à son milieu d’origine avec des eaux chaudes chutant rarement en dessous de 20 degrés Celsius. Un milieu idéal donc, pour sa prolifération. De plus, dans son milieu naturel, Pterois volitans n’a que très peu de prédateurs dont le poisson-flûte, et certaines espèces de mérous et carangue.
B) Anatomie
Certains vertébrés utilisent la sécrétion de toxines comme une stratégie offensive active pour chasser leurs proies. L’utilisation de venins comme moyen de défense est le cas de certains amphibiens (grenouilles venimeuses) et probablement de la plupart des espèces de poissons venimeux dont le poisson-lion (Saenz et al., 2017).
La caractéristique du genre Pterois dont fait partie le poisson lion est la présence de rayons épineux solides, considérés comme des défenses intégrées contre les espèces indigènes (Samhouri et Stier, 2021). Cette espèce possède treize longues épines sur la nageoire dorsale, trois sur la nageoire anale et une sur chaque pelvienne. Les épines dorsales, beaucoup plus longues que les autres, leur serviraient de stratégie d’intimidation pour faire paraître Pterois volitans plus gros aux prédateurs (Galloway et Porter, 2019).
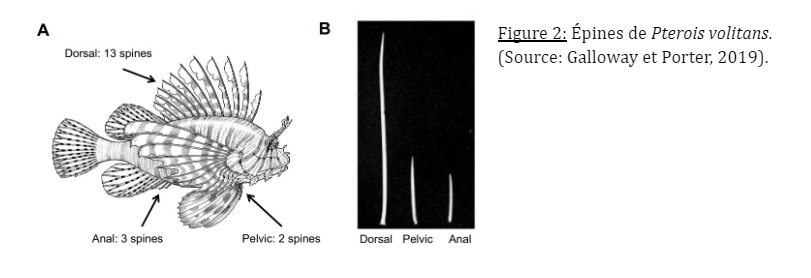
Les épines pelviennes et anales sont plus rigides que les épines dorsales qui peuvent se plier sous une charge latérale importante. La forme trilobée de ces rayons épineux est formée d’une paire de rainures latérales contenant le tissu glandulaire abritant le venin. Les épines et le tissu glandulaire sont recouverts d’une fine membrane qui se rompt lorsque les épines pénètrent un objet, libérant ainsi le venin (Halstead et al. 1955). Cependant toutes les épines ne sont pas venimeuses.
Composées de collagène minéralisé, elles résistent mieux à la flexion que les éléments du squelette des poissons cartilagineux et ont un fonctionnement similaire aux éléments squelettiques des poissons osseux. Elles peuvent aussi stocker beaucoup d’énergie ce qui permet aux poissons-lions de perforer leurs proies ou de se défendre contre des prédateurs.
Le venin produit est extrêmement toxique, la piqûre engendre une forte douleur ainsi qu’une inflammation marquée. Cependant, étant thermolabile, il peut être détruit par une source de chaleur supérieure à 60 degrés Celsius. Les épines, de par leur taille, leur rigidité et le venin qu’elles libèrent font de Pterois volitans un prédateur marin intimidant et agressif (Galloway et Porter, 2019).
Ce dernier possède des muscles bilatéraux spécialisés de la vessie natatoire, ce qui lui confère une meilleure flottabilité dans la colonne d’eau. Il présente également des communautés bactériennes dans le mucus de la peau, le rendant résistant aux maladies (Galloway et Porter, 2019). De surcroît, ses nageoires robustes facilitent la nage et peuvent permettre aux larves de Pterois volitans de rester dans un habitat pélagique favorable ou de s’orienter vers des zones de colonisation potentielles ( Mostowy et al., 2020).
C) Biologie
Pterois volitans connaît un mode de vie solitaire et nocturne. Dans son biotope naturel, il est considéré comme étant un grand prédateur, chassant de petits poissons ainsi que des crustacés à l’aide de sa bouche protractile qui lui permet d’engloutir ses proies. Les poissons-lions invasifs représentent une menace sans précédent pour la biodiversité et les pêcheries dans les eaux de l’Atlantique au large du sud-est des États-Unis (Ballew et al., 2016).
C’est une espèce ovipare, atteignant la maturité sexuelle entre 1,4 et 1,8 ans (Bustos-Montes et al., 2020) et pondant environ 40 000 œufs en eau libre ce qui facilite son expansion. Cependant contrairement à ses habitudes, dans les Caraïbes elle ne se reproduit pas en continu, elle a des reproductions saisonnières.
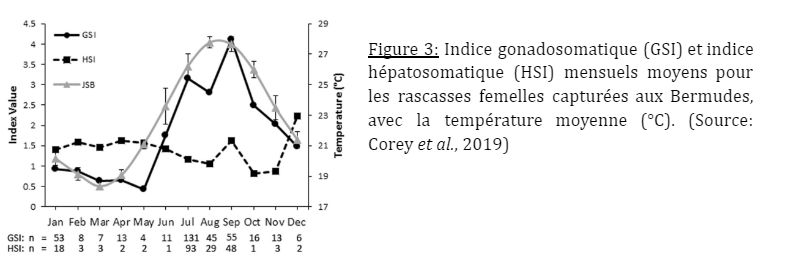
Il existe une différence morphologique entre Pterois volitans d’origine et les populations présentes dans la région des Caraïbes. Une reproduction différente entre ses populations est également notable. L’étude se passe au Bahamas, on observe que les spécimens sont plus grands et que la diminution de la température de l’eau en hiver affecte son activité reproductrice (Corey et al., 2019).
PARTIE 2: CONSEQUENCES SUR LE MILEU
A) Abondance
Le succès de l’invasion du poisson-lion dans l’Atlantique Ouest peut s’expliquer par son taux de dispersion rapide, ainsi qu’une croissance accrue de la population due à sa fécondité élevée. Plusieurs études confirment cette croissance rapide du poisson-lion. La température plus chaude dans le Golf du Mexique permet au poisson-lion de croître plus rapidement. Ceci et la croissance saisonnière observée dans les zones tempérées confirment l’effet de la température sur la variation de la croissance du poisson-lion (Bustos-Montes D. et al., 2020). La croissance est un trait important de l’histoire de la vie car la survie, la maturité sexuelle, le succès reproductif, le déplacement et la migration sont liés à la croissance et à la taille du corps.
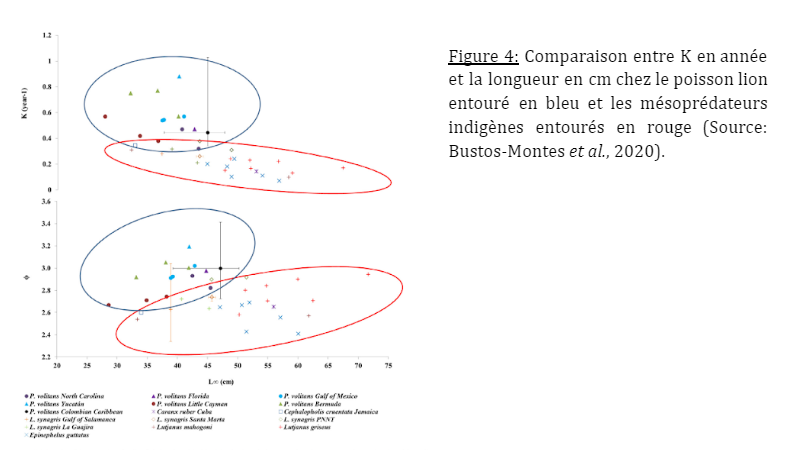
Des modèles se basant sur les otolithes peuvent permettre de déterminer l’âge, ce qui suggère une grande plasticité dans la croissance du poisson-lion. L’efficacité de l’envahisseur sur ses concurrents est notable, puisque le poisson-lion atteint sa taille maximale beaucoup plus rapidement que ses concurrents indigènes qui ont besoin d’un temps plus long pour atteindre les tailles de reproduction (Bustos-Montes et al., 2020). Les paramètres de croissance sont similaires entre les diverses zones des Caraïbes colombiennes mais différents entre les régions de la zone envahie. Cette variation est probablement due à des changements de température de l’eau, l’hétérogénéité de l’habitat, la complexité structurelle, la disponibilité de la nourriture, ainsi que le temps écoulé depuis la colonisation. L’efficacité de l’envahisseur par rapport à ses concurrents s’explique par la croissance rapide et l’âge précoce à la maturité du poisson lion.
La distribution des larves joue également un rôle dans l’abondance de ce poisson envahisseur. Ces larves ont été échantillonnées dans de nombreuses stations afin de déterminer leurs distributions horizontales et verticales.
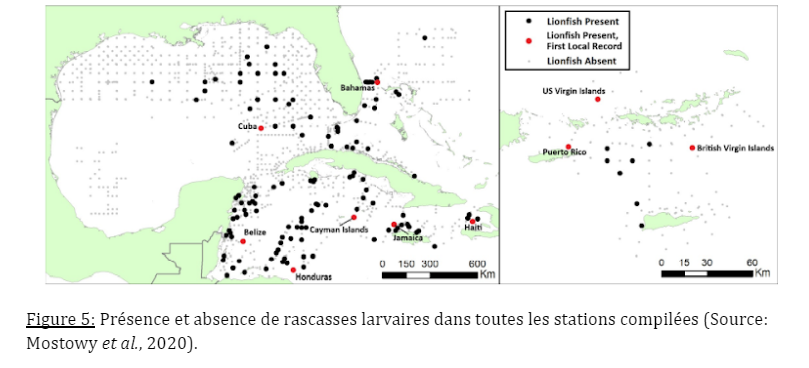
Dans la distribution horizontale, les larves de poisson-lion étaient présentes pour 142 stations échantillonnées sur les 1832 (7,8 %). Dans la distribution verticale, les larves de poisson-lion étaient réparties dans toute la colonne d’eau, de la surface à 75-100m de profondeur. Les larves étaient plus présentes dans les 50 premiers mètres de la colonne d’eau. L’effet de la profondeur d’échantillonnage sur la densité des larves de poisson-lion est donc significatif. D’un point de vue géographique, les densités larvaires les plus élevées ont été trouvées au large de la côte sud-est de la Floride et des Bahamas, tandis que des densités intermédiaires étaient généralement observées dans les Caraïbes. Enfin, les larves se montraient beaucoup plus rares dans le Golf du Mexique. Cette rareté rencontrée dans le nord du Golf du Mexique pendant l’échantillonnage au printemps et à l’été 2013 est particulièrement intéressante car le poisson-lion était déjà bien établi dans tout le nord du Golf à cette période. Une explication plausible serait un décalage entre l’établissement d’une population de poissons-lions dans une zone et la capacité de reproduction de cette population (Mostowy et al., 2020). Les larves de poisson-lion sont capables de modifier leur comportement entre le jour et la nuit. Les impacts physiologiques des températures de l’eau plus chaude sur les larves de poisson lion devraient faire l’objet d’une attention particulière, car le réchauffement de la température océanique peut élargir la fenêtre de dispersion larvaire et raccourcir leur durée de vie.
B) Régime alimentaire
Pterois volitans est un prédateur foudroyant et généraliste capable de consommer un large panel de proies. En effet, ce mésoprédateur va se concentrer sur toutes espèces de poissons indigènes ou de récifs coralliens ayant une taille inférieure voire égale à celle de son prédateur dans la limite de leur ouverture buccale (Albins, 2015). Le comportement de prédation du poisson-lion varie considérablement au cours de la journée (Green et al., 2011). Il y a un pic d’activité pendant la période crépusculaire ainsi qu’à l’aube car la densité de proies disponibles est plus élevée qu’en pleine journée. Cependant, le régime alimentaire de ce prédateur peut varier selon différents facteurs. Si la complexité de l’habitat est élevée en termes de structure, la prédation sera moins efficace. En revanche, si cette complexité est élevée en termes de compétition, alors la prédation sera ici plus efficace (South et al., 2017). De plus, la période de satiété du poisson-lion est d’environ 8 heures, hors dans la région des Caraïbes, la durée du jour est d’environ 11 heures. Le poisson-lion est donc obligé de chasser également au cours de la journée malgré la quantité plus faible de proies potentielles (Green et al., 2011). Ce piscivore se nourrit d’au moins 25 familles différentes de poissons, ce qui a un impact néfaste sur la survie de ces espèces puisqu’on parle d’une diminution de 94% de ces derniers (Albins, 2015) avant que Pterois volitans ne soit chassé par l’homme.
En effet, dans les eaux Caraïbéenne, cette rascasse dévore tout sur son passage. Elle avale les larves de poissons, de crevettes et de langouste, nourriture de nombreux habitants ainsi que de certaines espèces qui deviennent menacées d’extinction (mérou, vivaneau) (Ritger et al., 2020). Le choix du régime alimentaire chez les espèces marines est généralement dérivé de méthodes indirectes telles que le contenu de l’estomac et l’analyse des isotopes stables. Des facteurs présents dans les systèmes naturels sont à l’origine des décisions de recherche de nourriture (caractéristiques de la proie, état du prédateur, conditions environnementales).
L’objectif des travaux portant sur le choix du régime alimentaire chez le poisson-lion a pour objectif de mieux comprendre l’impact du poisson-lion sur les récifs, ainsi que d’augmenter les prédictions sur la façon dont l’expansion continue de Pterois volitans peut se produire (Ritger et al., 2020).
Des travaux récents ont fourni des preuves de sélectivité chez le poisson lion envahissant. Le choix de leur régime alimentaire à été analysé en présentant à des rascasses capturées à l’état sauvage des assemblages de proies d’espèces différentes. Trois types de proies sont utilisées (chromis brune, tête bleue et gobie vitreux) avec des caractéristiques similaires qui sont à la fois très abondantes sur les récifs coralliens ainsi que dans le régime alimentaire des rascasses. De plus, le comportement de recherche de nourriture est dépendant de la condition, puisque les poissons-lions, ayant une condition corporelle plus élevée, sont plus susceptibles de présenter un comportement sélectif de recherche de nourriture (Ritger et al., 2020).
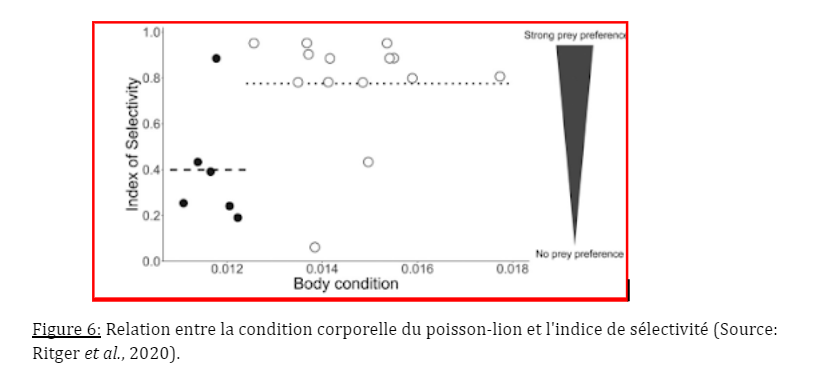
Les valeurs de l’indice de sélectivité varient de 0,06 à 0,95 (Fig. 2), ce qui indique que le poisson-lion a dévié d’une stratégie généraliste pure de consommation de ressources proportionnelle à la disponibilité des ressources.
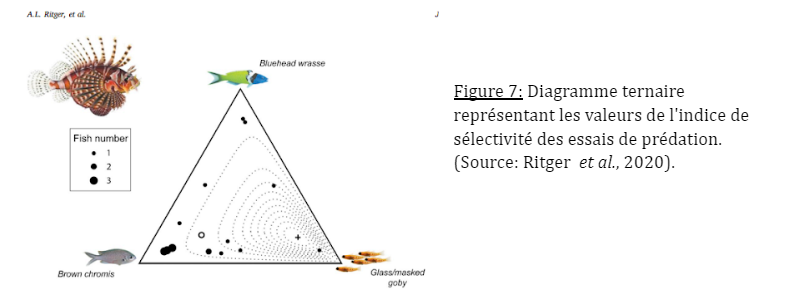
La plupart des poissons-lions présentaient une préférence pour la chromis brune qui reste plus consommée que la tête bleue ou que le gobie vitreux/masqué (Fig. 7).
Cette étude fournit les premières preuves expérimentales, d’un choix préférentiel de proies chez le poisson-lion, même parmi des proies possédant des traits comportementaux et morphologiques similaires. La majorité des individus ont fait preuve d’une sélection active de leurs espèces proies, ce qui est incompatible avec une stratégie généraliste pure de recherche de nourriture proportionnelle à l’abondance des espèces ciblées (Ritger et al., 2020).
C) Impact
Les résultats obtenus sur le régime régime alimentaire du poisson-lion ont des implications importantes pour le suivi de son invasion, ainsi que pour l’estimation des impacts potentiels directs et indirects sur les communautés de poissons de récifs indigènes dans cette région (Dahl, 2014).
Le poisson-lion réduit le recrutement des poissons de récifs indigènes (Harris et al., 2019) et menace la biodiversité des récifs coralliens de la région (Arias-Gonzalez, 2011). Son succès en tant qu’espèce envahissante est dû à sa prédation et sa fécondité élevées, ainsi qu’à sa croissance rapide et à l’absence de prédateurs. Sa présence dans les récifs a eu pour conséquence, une diminution de la densité et de la biomasse des poissons indigènes et une compétition pour l’espace et la nourriture avec les espèces d’un niveau trophique similaire (Sabido-Itzá et al., 2019). Ce prédateur transforme les communautés écologiques en modifiant le comportement des proies, la structure du réseau alimentaire et en affectant la dynamique des populations et des communautés de proies. Les effets au niveau de la communauté dépendent, en partie, du comportement de recherche de nourriture des prédateurs, qui peut varier en réponse à l’hétérogénéité spatiale des proies , aux différences spécifiques, au niveau de satiété, de l’intensité et de l’activité du prédateur (Ritger et al., 2020). Lorsque des prédateurs invasifs sont introduits dans un système, ils ont la capacité de perturber les assemblages de la communauté en réduisant le nombre de proies, en altérant les réseaux alimentaires et en provoquant des des changements significatifs dans la reproduction et la survie des espèces indigènes. Les effets directs du poisson-lion pourraient être combinés à d’autres facteurs de stress tels que la surpêche et la pollution dans les récifs des Caraïbes entraînant une crise de la biodiversité. Prédateurs voraces, les poissons-lions ont la capacité d’altérer dramatiquement les écosystèmes marins ; aux Bahamas, par exemple, en réduisant la biomasse et le recrutement des poissons de récif indigènes de 65% et 79% respectivement et en impactant la diversité des herbivores, qui a précédé le passage d’un récif mésophotique dominé par les coraux à un récif dominé par les macroalgues (Kleitou et al., 2021). Le poisson-lion, par cascade trophique, dérègle l’équilibre de l’écosystème.
Les épines venimeuses du poisson-lion constituent également un danger pour l’homme dans toutes les aires de répartition (Norton et al., 2021).
PARTIE 3: REGULATION DE LA POPULATION
Les impacts ainsi que la surface d’habitat ne faisant que croître, des solutions ont dûes être mises en place afin d’inhiber la croissance exponentielle de Pterois volitans. Ces solutions sont souvent médiées soit par l’Homme ou par des processus naturels.
A) Solutions médiées par l’Homme
Parmi les solutions relevées afin de réguler Pterois volitans, certaines pourraient être effectuées par les humains. Les gestionnaires des ressources naturelles ont pour objectif de réduire l’abondance des espèces envahissantes à des niveaux qui minimisent les impacts écologiques négatifs (Malpica-Cruz et al., 2016). Cette régulation d’origine humaine peut être infligée à différents stades de vie du poisson-lion. Tout d’abord à un stade juvénile suite à la destruction de leur habitat. En effet, il est important de déterminer les facteurs impliqués dans la survie des larves de poisson-lion afin de mieux contrôler les populations. De plus, il a été montré que les poissons-lions juvéniles ont tendance à se situer dans les mangroves, d’où l’importance pour les plongeurs de détruire ces mangroves afin de réguler leur croissance à partir du point de départ. (Johnson et al., 2016).
Le poisson-lion peut également être éradiqué de manière plus générale, sans catégorie d’âge. Ce contrôle de la population était à la base uniquement effectué par des plongeurs-pêcheurs conscients des dégâts causés par cette espèce invasive. En effet, cette espèce est une source de préoccupation car elle peut affecter les communautés de pêcheurs locales et les conditions écologiques estuariennes (Prakash, 2012). Toutefois, de plus en plus de plongeurs à but récréatifs se sensibilisent au sujet de cet envahisseur ainsi que ses impacts et cela les encourage à prendre davantage part à la capture des poissons-lions. En outre dans certains espaces maritimes comme le Parc National Arrecife Alacranes, de nombreuses campagnes sont mises en place afin de sensibiliser au maximum le public concernant les impacts de Pterois volitans dans le but de les inciter à prendre part à la capture de ces derniers (Cen-Lopez et al., 2020). Cependant, il peut y avoir des niches de poissons-lions très en profondeur dans le Golf du Mexique, donc inaccessibles aux plongeurs pour l’élimination, par conséquent, l’éradication de ce dernier ne peut être totale. (Mostowy, 2020).
B) Processus naturels mis en jeu
Ensuite, malgré le fait qu’il interagit principalement avec des proies, le poisson-lion se situe dans des environnements contenant également des espèces prédatrices indigènes. Il y a aussi la présence d’espèces compétitrices comme le mérou indigène. Ces derniers pourraient avoir un rôle en tant que régulateurs possibles du succès de la colonisation du poisson-lion sur les récifs. Toutefois la régulation de Pterois volitans grâce aux prédateurs et compétiteurs indigènes est vaine. En effet, les poissons-lions se développent très rapidement et bien que leur taille soit inférieure à celle de leurs prédateurs naturels et supérieure à la taille de leurs compétiteurs, leur croissance est telle que l’impact des prédateurs indigènes sur les poissons-lions est moindre. En plus de n’avoir aucun effet sur cette espèce invasive, il se pourrait même que sur le long terme, ces relations deviennent désavantageuses pour les espèces qui entourent Pterois volitans car ce dernier n’est pas au maximum de sa capacité de peuplement. Le poisson-lion pourrait donc avoir un fort avantage pour trouver de la nourriture par rapport aux autres espèces en compétition (De la Guardia et al., 2017). De plus, les actions de prédation des individus indigènes envers le poisson-lion sont rarement directes, ce qui diminue l’action de régulation de cette espèce (Johnson et al., 2016).
D’autres processus d’origine naturelle peuvent également entrer en jeu dans la régulation de cette espèce invasive. Cependant, ces facteurs agissent à une échelle microscopique, de l’ordre des gènes mais aussi de l’ordre des parasites.
Les poissons-lions peuvent être confrontés à de nombreux parasites selon la région dans laquelle ils se situent. Par exemple, le trématode L.floridense est réparti différemment selon les latitudes étudiées. Cependant, il y a également une variation des effets des parasites selon les espèces touchées. En effet, il a été observé que les espèces indigènes qui constituent des proies pour le poisson-lion sont plus facilement affectées par les parasites que ce dernier, ce qui suggère que les parasites pourraient avoir un impact différent sur l’espèce indigène et l’envahisseur. Ici également, le parasitisme de l’espèce envahissante pourrait être un moyen de régulation cependant des études complémentaires seraient nécessaires afin de le confirmer ou non (Sellers et al., 2015).
Enfin, comme toutes les espèces qui composent le monde du vivant, Pterois volitans est sujette à des variations génétiques au cours du temps. Il se pourrait que l’invasion des poissons-lions soit affectée par des changements génétiques dans le temps et dans l’espace, bien que d’autres hypothèses telles que les pressions sélectives différentes entre l’ADN mitochondrial et nucléaire ne peuvent pas être complètement écartées. (Pérez-Portela et al., 2018).
C) Expansion à l’échelle mondiale
Enfin, bien que cette synthèse ait mis en lumière uniquement l’impact de Pterois volitans au sein d’un écosystème tropical, il faut savoir que cette espèce sévit dans de nombreuses autres zones géographiques dans le monde. C’est le cas en Mer Méditerranée, où le poisson-lion intègre de plus en plus ce milieu depuis 1992. Les applications de régulation de cette espèce en Mer Méditerranée sont donc fortement similaires car inspirées des méthodes utilisées dans les zones des Caraïbes et des côtés Nord-Américaines. Ces méthodes reprennent la sensibilisation des citoyens afin d’augmenter leurs connaissances et leurs contributions dans la lutte des espèces invasives. Les prélèvements de poisson-lion sont également utilisés en Mer Méditerranée car ils permettent de réguler de manière considérable leur densité au sein d’un milieu, cependant l’efficacité de ces prélèvements dépend des capacités des plongeurs. De plus, le fait que Pterois volitans soit comestible peut encourager la chasse de ce dernier (Kleitou et al., 2021). Il y a donc nécessité de suivre continuellement l’expansion de cette espèce grâce aux données locales dans le but de protéger la biodiversité indigène. Par exemple, la gestion de la répartition du poisson-lion dans les Caraïbes a permis de mieux anticiper et de contrôler leur expansion (Phillips et al., 2021).
CONCLUSION
Cette espèce invasive coriace induit de multiples impacts à différentes échelles. À travers son régime alimentaire, son abondance et sa prolifération. Ce piscivore détruit progressivement son environnement. Diverses solutions ont été mises en place dans le but de réduire son impact écologique. Ces stratégies de gestion reposent principalement sur la promotion de la prédation et de la consommation humaine (Noll et al. 2020). De futures études pourraient utiliser des épines de poissons-lion dans le domaine de la médecine. Elles peuvent être utiles pour créer des aiguilles de seringues ou des pistons réutilisables qui seraient stérilisés et rechargés, ceci réduirait les déchets biomédicaux et les coûts d’élimination (Galloway et Porter, 2019).
BIBLIOGRAPHIE
Albins Mark A. (2015), “Invasive Pacific lionfish Pterois volitans reduce abundance and species richness of native Bahamian coral-reef fishes”, Marine Ecology Progress Series, vol. 522: 231–243 (DOI: 10.3354/meps11159)
Arias-Gonzalez J.E (2011) “Predicted impact of the invasive lionfish Pterois volitans on the food web of a Caribbean coral reef” , Vol.111(7), p.917-925 (DOI: 10.1016/j.envres.2011.07.008)
Ballew N.G., Bacheler N.M., Kellison G.T., Schueller A.M. (2016), “Invasive lionfish reduce native fish abundance on a regional scale”, scientific reports, article numéro 32169: 1-7 (DOI: 10.1038/srep32169)
Benjamin B., Norton, M.D., Scott A. (2021) “Lionfish envenomation in Caribbean and Atlantic waters: Climate change and invasive species”, International Journal of Women’s Dermatology, vol. 7: 120-123
Bhattacharyya J., Pal S. (2011) “Coexistence of competing predators in a coral reef ecosystem” Vol.12(2), p.965-978 (DOI: 10.1016/j.nonrwa.2010.08.020).
Bustos-Montes D., Wolff M., Sanjuan-Muñoz A., Arturo Acero P. (2020) “Growth parameters of the invasive lionfish (Pterois volitans) in the Colombian Caribbean”, Regional Studies in Marine Science, vol. 38: article n°101362 (DOI: 10.1016/j.rsma.2020.101362)
Cen-López A., Aguilar-Perera A. (2020) “Perceptions of diver-fishermen and recreational divers on lionfish as a threat in the Parque Nacional Arrecife Alacranes, southern Gulf of Mexico”Ocean and Coastal Management, vol. 1931 : n°105225 (DOI:10.1016/j.ocecoaman.2020.105225)
Corey E., Pitt J., Oliveira K., Morris Jr J. A., Potts J., Bernal D. (2019) “The life history characteristics of invasive lionfish (Pterois volitans and P. miles) in Bermuda”, Environmental Biology of Fishes, vol.102: 887-900 (DOI:10.1007/s10641-019-00877-4)
Dahl K.A., Patterson III W.F. (2014) “Habitat-specific density and diet of rapidly expanding invasive red lionfish, Pterois volitans, populations in the northern Gulf of Mexico” PLoS ONe, vol. 9 : n°105852 (DOI:10.1371/journal.pone.0105852)
De la Guardia E, Cobián Rojas D , Espinosa L, Hernández Z (2017), Distribución y abundancia del pez león Pterois volitans (Scorpaeniformes: Scorpaenidae) y especies nativas asociadas en el Parque Marino Cayos de San Felipe, Cuba. Revista de Biologia Tropical vol.65(1):117-125
Galloway K. A., Porter M. E. (2019) “Predator–Prey Interactions Examined Using Lionfish Spine Puncture Performance”, Integrative Organismal Biology pp: 1–12 (DOI:10.1242/jeb.197905)
Green S.J., Akins J.L., Coté I.M. (2011) “Foraging behaviour and prey consumption in the Indo-Pacific lionfish on Bahamian coral reefs”, Marine Ecology Progress Series vol. 433: 159-167 (DOI: 10.3354/meps09208)
Halstead B.W., Chitwood M.J., Modglin F.R. (1955) ”The anatomy of the venom apparatus of the zebrafish, Pterois volitans(Linnaeus)” the anatomical record, vol. 122 : 317-323 (DOI:10.1002/ar.1091220304)
Harris H.E., William F. Patterson III , Robert N.M. Ahrens , Micheal S. Allen (2019) “Detection and removal efficiency of invasive lionfish in the northern Gulf of Mexico” Vol. 213, 22-32
Johnson E.G., Swenarton M.K. (2016) “Age, growth and population structure of invasive lionfish (Pterois volitans/miles) in northeast Florida using a length-based, age-structured population model”, PeerJ vol. (DOI 10.7717/peerj.2730)
Kleitou P., Rees S., Cecconi F., Kletou D., Savva I., Cai L.L., Hall-Spencer J.M. (2021) “Regular monitoring and targeted removals can control lionfish in Mediterranean Marine Protected Areas”, Aquatic Conservation: Marine and Freshwater Ecosystems, vol. 31: 2870-2882 (DOI: 10.1002/aqc.3669)
Malpica-Cruz L., Chaves L., Côté I.M. (2016) “Managing marine invasive species through public participation: Lionfish derbies as a case study”, Marine Policy vol. 74 : 158-164
Mostowy J., Malca E., Rasmuson L., Vásquez-Yeomans L.,Gerard T., Sosa Cordero E., Carrillo L., Lamkin J T. (2020) “Early life ecology of the invasive lionfish (Pterois spp.) in the western Atlantic”, Plos One (DOI; 10.1371/journal.pone.0243138)
Noll S., Davis B. (2020) “The Invasive Species Diet: The Ethics of Eating Lionfish as a Wildlife Management Strategy” Ethics, Policy and Environment, vol. 23 : 320-335 (DOI:10.1080/21550085.2020.1848189)
Pérez-Portela R., Bumford A., Coffman B., Wedelich S., Davenport M., Fogg A., Swenarton M.K.,Coleman F., Johnston M.A., Crawford D.L., Oleksiak M.F., (2018) “Genetic homogeneity of the invasive lionfish across the Northwestern Atlantic and the Gulf of Mexico based on Single Nucleotide Polymorphisms”. Scientific reports (DOI; 10.1038/s41598-018-23339-w)
Phillips E.W., Kotrschal A. (2021) “Where are they now? Tracking the Mediterranean lionfish invasion via local dive centers” Journal of Environmental Management, vol. 29815 : n° 113354 (DOI:10.1016/j.jenvman.2021.113354)
Pimentel D., Zuniga R., Morrison D. (2005) “Update on the environmental and economic costs associated with alien-invasive species in the United States” Ecological Economics, vol. 52 : 273-288
Prakash S.S. (2012) “Invasion and abundance of reef inhabiting fishes in the Vellar estuary, southeast coast of India, especially the lionfish Pterois volitans Linnaeus.”
Ricciardi A., Palmer M.E., Yan N.D. (2011) “Should Biological Invasions Be Managed as Natural Disasters?”, BioScience, vol. 61: 312–317
Ritger A.L., Fountain C.T., Bourne K., Martín-Fernández J.A. , Pierotti M.E.R. (2020) “Diet choice in a generalist predator, the invasive lionfish (Pterois volitans/miles)”, Journal of Experimental Marine Biology and Ecology, vol 524: article n°151311 (DOI: 10.1016/j.jembe.2020.15131)
Sabido-Itzá M.M., García-Rivas M.C. (2019) “Record of abundance, spatial distribution and gregarious behavior of invasive lionfish Pterois spp. (Scorpaeniformes: Scorpaenidae) in coral reefs of Banco Chinchorro Biosphere Reserve, southeastern Mexico” Latin American Journal of Aquatic Research, vol.47: 349-355 (DOI; 10.3856/vol47-issue2-fulltext-15)
Sáenz A., Ortiz N., Lomonte B., Rucavado A., Díaz C. (2017) “Comparison of biochemical and cytotoxic activities of extracts obtained from dorsal spines and caudal fin of adult and juvenile non-native Caribbean lionfish (Pterois volitans/miles)”Toxiconvol. 137 : 158-167
Samhouri J.F., Stier A.C. (2021) “Ecological impacts of an invasive mesopredator do not differ from those of a native mesopredator: lionfish in Caribbean Panama”, Coral Reefs, vol 40: 1593-1600 (DOI 10.1007/s00338-021-02132-8)
Sellers A.J. , Ruiz G.M., Leung B., Torchin M.E., (2015) Regional Variation in Parasite Species Richness and Abundance in the Introduced Range of the Invasive Lionfish, Pterois volitans; PlOS ONE (DOI 10.1371/journal.pone.0131075)
South J., Dick J., McCard M., Barrios-O’Neill D., Anton A. (2017) “Predicting predatory impact of juvenile invasive lionfish (Pterois volitans) on a crustacean prey using functional response analysis: effects of temperature, habitat complexity and light regimes”, Environ Biol fish, vol. 100: 1155–1165 (DOI 10.1007/s10641-017-0633-y)
Vilà M., Hulme P.E. (2017) “Non-native Species, Ecosystem Services, and Human Well-Being” Invading Nature – Springer Series in Invasion Ecology, vol. 12 : 1-14 (DOI: 10.1007/978-3-319-45121-3_1)
2 thoughts on “L’impact d’une espèce invasive sur son écosystème: Pterois Volitans dans la région des Caraïbes et du Golf du Mexique”
Merci beaucoup pour cette synthèse très intéressante !
Très intéressant.